生產許可服務咨詢
1、申請表(區分進口和境內醫療器械注冊申請表)。
2、證明文件
境內:
(1)企業營業執照副本復印件和組織機構代碼證復印件;
(2)創新醫療器械特別審批申請審查通知單;
(3)受托企業生產許可證和委托協議(針對樣品委托其他企業生產的
醫療器械注冊。)
(2)和(3)是針對按照《創新醫療器械特別審批程序審批》的境內醫
療器械申請注冊。
境外:
(1)上市銷售證明文件;
(2)企業資格證明文件;
(3)代理人委托書;
(4)代理人承諾書;
(5)代理人營業執照副本復印件或者機構登記證明復印件。
3、醫療器械安全有效基本要求清單
4、綜述資料
4.1 概述
(1)產品的管理類別;
(2)分類編碼;
(3)名稱的確定依據。
4.2產品描述(先判斷產品的有源無源)
(1)產品工作原理;
(2)產品工作機理;
(3)產品結構組成;
(4)產品主要原材料(針對無源);
(5)產品主要功能及其組成部件(關鍵組件和軟件)的功能(針對有
源);
(6)產品的圖示說明。
4.3 型號規格
4.4 包裝說明
(1)產品與包裝的情況;
(2)無菌醫療器械的包裝信息。(如是無菌醫療器械)
4.5 適用范圍和禁忌癥
(1)適用范圍;
(2)預期使用環境;
(3)適用人群;
(4)禁忌癥。
4.6參考的同類產品或前代產品應當提供同類產品
(1)申請注冊產品的研發背景和目的;
(2)產品與參考產品的比較;
4.7其他需要說明的內容
(1)已獲得批準的部件或配合使用的附件的批準文號和批準文件復
印件;(如有)
(2)與其他醫療器械或通用產品組合說明;(如有)
(3)組合醫療器械間存在的物理、電氣等連接方式。(如有組合)
5、研究資料
5.1 產品性能的研究
(1)產品性能研究資料;
(2)產品技術要求的研究;
(3)編制說明。
5.2 生物相容性評價研究
(1)生物相容性評價的依據和方法;
(2)產品所用材料的描述及與人體接觸的性質;
(3)實施或豁免生物學試驗的理由和論證;
(4)對于現有數據或試驗結果的評價。
5.3生物安全性研究
(1)生物活性物質的生物安全性研究資料;
(2)來源及驗證試驗;
(3)工藝驗證的簡要總結;
5.4滅菌/消毒工藝研究
(1)生產企業滅菌;
(2)終端用戶滅菌;
(3)殘留毒性;
(4)終端用戶消毒;
5.5產品有效期和包裝研究
(1)有效期的確定;
(2)有效期的確定(針對有限次重復使用的醫療器械);
(3)包裝及包裝完整性。
5.6臨床前動物試驗
(1)研究目的;
(2)研究結果;
(3)研究記錄。
5.7軟件研究(針對含有軟件的產品)
(1)軟件基本信息;
(2)軟件實現過程;
(3)軟件的核心算法。
(4)軟件的命名規則的聲明。
5.8其他資料
證明產品安全性、有效性的其他研究資料。
6. 生產制造信息(先判斷有源和無源產品)
6.1 無源產品/有源產品生產過程信息描述
(1)產品生產加工工藝;
(2)過程控制點;
6.2生產場
7. 臨床評價資料
7.1臨床試驗方案
(一)臨床試驗的題目;
(二)臨床試驗的目的、背景和內容;
(三)臨床評價標準;
(四)臨床試驗的風險與受益分析;
(五)臨床試驗人員姓名、職務、職稱和任職部門;
(六)總體設計,包括成功或失敗的可能性分析;
(七)臨床試驗持續時間及其確定理由;
(八)每病種臨床試驗例數及其確定理由;
(九)選擇對象范圍、對象數量及選擇的理由,必要時對照組的設置;
(十)治療性產品應當有明確的適應癥或適用范圍;
(十一)臨床性能的評價方法和統計處理方法;
(十二)副作用預測及應當采取的措施;
(十三)受試者《知情同意書》;
(十四)各方職責。
7.2臨床實驗報告
(一)試驗的病種、病例總數和病例的性別、年齡、分組分析,對照組的設置(必要時);
(二)臨床試驗方法;
(三)所采用的統計方法及評價方法;
(四)臨床評價標準;
(五)臨床試驗結果;
(六)臨床試驗結論;
(七)臨床試驗中發現的不良事件和副作用及其處理情況;
(八)臨床試驗效果分析;
(九)適應癥、適用范圍、禁忌癥和注意事項;
(十)存在問題及改進建議。
8. 產品風險分析資料
8.1風險分析
8.2風險評價
8.3風險控制措施的實施和驗證結果
8.4剩余風險的可接受性評定
9. 產品技術要求
一、產品名稱
二、產品型號/規格及其劃分說明。
三、性能指標。
(1)材料
(2)外觀
(3)硬度(如適用)
(4)表面粗糙度
(5)尺寸
(6)耐腐蝕性能(如適用,如不銹鋼)
四、檢驗方法。(針對性能指標的檢驗。)
(1)材料檢驗方法
(2)外觀檢驗方法
(3)硬度檢驗方法(如適用)
(4)表面粗糙度檢驗方法
(5)尺寸檢驗方法
(6)耐腐蝕性能檢驗方法(如適用,如不銹鋼)
五、對于第三類體外診斷試劑類產品,產品技術要求中應以附錄形式明確主要原材料、生產工藝及半成品要求。
六、醫療器械產品技術要求編號為相應的注冊證號(備案號)。擬注冊(備案)的產品技術要求編號可留空。
10. 產品注冊檢驗報告
10.1 注冊檢驗報告
10.2 預評價意見
11. 產品說明書和最小銷售單元的標簽樣稿
11.1說明書
(1)產品名稱、型號、規格;
(2)注冊人或者備案人的名稱、住所、聯系方式及售后服務單位,
進口醫療器械還應當載明代理人的名稱、住所及聯系方式;
(3)生產企業的名稱、住所、生產地址、聯系方式及生產許可證編
號或者生產備案憑證編號,委托生產的還應當標注受托企業的名稱、住所、生產地址、生產許可證編號或者生產備案憑證編號;
(4)醫療器械注冊證編號或者備案憑證編號;
(5)產品技術要求的編號;
(6)產品性能、主要結構組成或者成分、適用范圍;
(7)禁忌癥、注意事項、警示以及提示的內容;
(8)安裝和使用說明或者圖示,由消費者個人自行使用的醫療器械
還應當具有安全使用的特別說明;
(9)產品維護和保養方法,特殊儲存、運輸條件、方法;
(10)生產日期,使用期限或者失效日期;
(11)配件清單,包括配件、附屬品、損耗品更換周期以及更換方
法的說明等;
(12)醫療器械標簽所用的圖形、符號、縮寫等內容的解釋;
(13)說明書的編制或者修訂日期;
(14)其他應當標注的內容。
11.2最小銷售單元的標簽樣稿
(1)產品名稱、型號、規格;
(2)注冊人或者備案人的名稱、住所、聯系方式,進口醫療器械還
應當載明代理人的名稱、住所及聯系方式;
(3)醫療器械注冊證編號或者備案憑證編號;
(4)生產企業的名稱、住所、生產地址、聯系方式及生產許可證編
號或者生產備案憑證編號,委托生產的還應當標注受托企業的名稱、住所、生產地址、生產許可證編號或者生產備案憑證編號;
(5)生產日期,使用期限或者失效日期;
(6)電源連接條件、輸入功率;
(7)根據產品特性應當標注的圖形、符號以及其他相關內容;
(8)必要的警示、注意事項;
(9)特殊儲存、操作條件或者說明;
(10)使用中對環境有破壞或者負面影響的醫療器械,其標簽應當
包含警示標志或者中文警示說明;
(11)帶放射或者輻射的醫療器械,其標簽應當包含警示標志或者
中文警示說明。
12.符合性聲明
(一)申請人聲明本產品符合《醫療器械注冊管理辦法》和相關法
規的要求;聲明本產品符合《醫療器械分類規則》有關分類的要求;聲明本產品符合現行國家標準、行業標準,并提供符合標準的清單。
(二)所提交資料真實性的自我保證聲明(境內產品由申請人出具,
進口產品由申請人和代理人分別出具)。
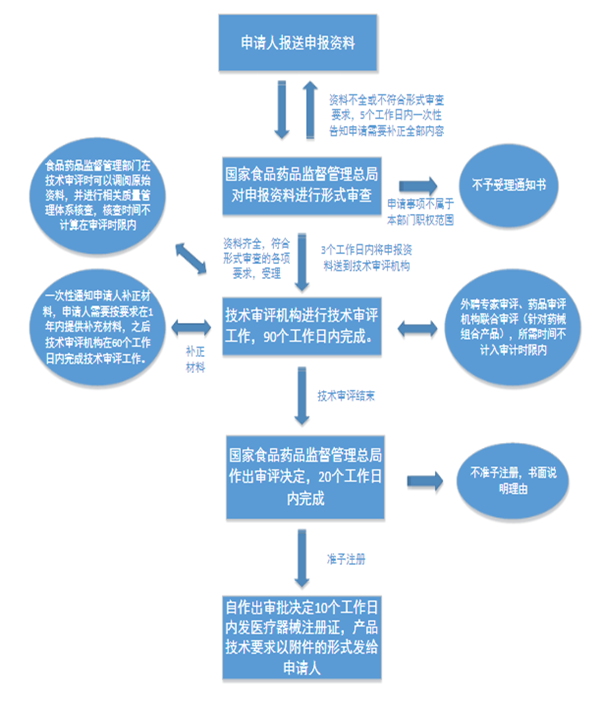
各省市產品注冊流程以所在省市官網公布要求為準,可全權委托秉實企業管理咨詢有限公司進行屬地注冊法規差異要求確認,秉實公司可提供三類醫療器械注冊全程代理服務!
掃二維碼用手機看


